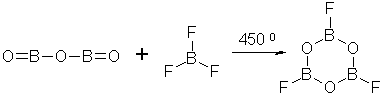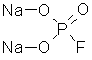Фтор
2Al + 3F2 = 2AlF3 + 2989 кДж
2Fe + 3F2 = 2FeF3 + 1974 кДж
3F2 + 3H2O = F2O↑ + 4HF + H2O2 (взрывной характер реакции)
H2 + F2 = 2HF + 547 кДж
Hal2 + F2 = 2HalF
см. реакции с благородными газами
3BrF5 + Br2 = 5BrF3
2ClF3 + Br2 = 2BrF3 + Cl2
5ClF3 + 4I2 = 3IF5 + 5ICl
Note Bene: ClF, ClF3, ClF5, BrF3, BrF5, IF5, IF7
Si + 2F2 = SiF4 + 1615 кДж
Xe + F2 = XeF2 + 152 кДж
RClm + SbF3 = RClm-nFn (реакция Свартса)
C6H5NH2 (HNO2, HBF4) à C6H5─N2+BF4- (t°) à C6H5F + N2 + BF3 (реакция Шимана)
CHClF2 (t°, -HCl) à CF2=CF2 à (-CF2-)n
nC + 2nF2 à CF4, C2F6, C3F8, C6F12, C6F12 (циклич.) – не ядовиты
nC (графит) + n/2F2 (200-450°) à (CF)n «твердая смазка» (туда же MoS2 и графит)
(CF)n (t°) à C + CF4 + C2F6 + C3F8
CaF2 + H2SO4 (конц., 96-99%) = CaSO4 + 2HF
HF (4000°) à H + F (40% от общ.)
TlF3 + H2O = Tl(OH)3 + 3HF
3R─Mg─Hal (реактив Гриньяра) + BF3 = R3B + 3Mg(Hal)F
Na2B4O7*10H2O + 6CaF2 + 8H2SO4 = 4BF3 + 2NaHSO4 + 6CaSO4 + 17H2
Na2B4O7*10H2O + 12HF = Na2[O(BF3)4] + 16H2O
2B2O3 + 12NH4F = (NH4)2[O(BF3)4] + 10NH3 + 5H2O
(NH4)2[O(BF3)4] + H2S2O7 = 4BF3 + 2H2SO4 + 2NH3 (H2S2O7 = H2SO4*SO3)
2(BO)n + 2nSF4 = nB2F4 (газ) + 2nSOF2
CH2=CH2 + B2F4 = F2BCH2CH2BF2
Note Bene: KBF4, NaBF4, NH4BF4
H3BO3 + 3HF ó HBF3(OH) + 2H2O
HBF3(OH) + HF ó HBF4 + H2O α20 (HBF4) = 1,38
Note Bene: AlF3*nH2O n=9, 3.5, 3, 1, 0.5
4Al + 6OF2 = 4AlF3 + 3O2
3CF2=CF2 + 2OF2 = 2CF3CF3 + 2COF2
3HF + Al(OH)3 = AlF3 + 3H2O
H2SiF6 + 2Al(OH)3 + 2H2O = 2AlF3*3H2O + SiO2
Al2O3*3H2O + H2SiF6 = 2AlF3 + SiO2 + 4H2O
SiO2 + 2CaF2 + 2H2SO4 = SiF4 + 2CaSO4 + 2H2O
3SiF4 + 2H2O = 2H2SiF6 + SiO2
3SiF4 + (x+2)H2O = 2H2SiF6 + SiO2*xH2O
SiF4 + 2NaF = Na2SiF6
SiF4 + 3RMgHal (реактив Гриньяра) = R3SiF + 3Mg(Hal)F
SiO2 + 6HF = H2SiF6 + H2O
Na2SiF6 + 6NaOH = 6NaF + Na2SiO3 + 3H2O
H2SiF6 + 2NaOH = Na2SiF6 + 2H2O
H2SiF6 + MgCO3 = MgSiF6 + CO2 + H2O
H2SiF6 + 2NaCl = Na2SiF6 + 2HCl
SiF62- + 2H2O ó SiO2 + 4H+ + 6F- K=5,4*10-27
H2SiF6 + 6NaOH + (x-4)H2O = 6NaF + SiO2*xH2O
3Na2SiF6 + 4Al (t°) = 2Na3AlF6 + 2AlF3 + 3Si Na3AlF6 – фторирование водопроводной воды
Note Bene: PF3, PF5, P2F4, O=PF3
Cu + 2NF3 = CuF2 + N2F4
SO2 + NF3 = SOF2 + NOF
SOF2 + 2NOF = SF4 + NO2 + NO
SO2 + 2NF3 = SO2F2 + N2F4
V2O5 + 3NF3 = 2VOF3 + 3NOF
VOF3 + NOF = NO+(VOF4)-
V2O5 + 6NOF = 2VOF3 + 3NO + 3NO2
N2F4 + N2O5 = ONNF2 + ...
N2F4 + SF4 = SF5NF5 + ...
P2O5 + 2HF + H2O = 2H2PO3F – монофторангидрид фосфорной кислоты
2NaOH + H2PO3F = 2H2O + Na2PO3F – компонент зубных паст
|
|
|
|
|
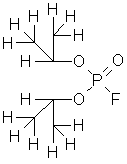
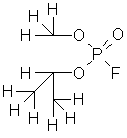
Диизопропиловый эфир фторангидрида фосфорной кислоты
|
Зарин (смертоносный яд) |
Натриевая соль фторангидрида фосфорной кислоты
|
HPO2F2 + H2O = H2PO3F + HF (такие кислоты иногда называют сверхкислотами)
HSO3F – жидкость с t°кип 162,7°C и плотностью 1,7264 (25°), термически устойчива (до 900°).
S + 2HSO3F (t°) = 3SO2 + 2HF
NaCl + HSO3F = NaSO3F + HCl
MgCl2 + 2HSO3F = Mg(SO3F)2 + 2HCl
AlCl3 + 2HSO3F = ClAl(SO3F)2 + 2HCl
C6H6 + HSO3F à C6H5SO2F + H2O à C6H5SO3H + HF
C6H5SO2F + C6H6 = C6H5SO2C6H5
RNH2 + HSO3F = RNHSO3H + HF
RCOOH + HSO3F = RCOF + H2SO4
HF + SO3 = HSO3F η – 98,5%
2FClO3 (>470°) = 2FCl + 3O2
FClO3 + KOH = KClO4 + HF
FClO3 + AlCl3 ó ClO3+ + AlCl3F-
C6H6 + ClO3+ = C6H5ClO3 + H+
C6H6 + FClO3 (кат.: AlCl3) = C6H6ClO3 перхлорилбензол
KClO3 + F2 = FClO3 + KF
KClO4 + 2HSO3F = KF + H2SO4 + FClO3
KClO4 + 2HF + SbF5 (40-50°) = FClO3 + KSbF6 + H2O (лабораторный способ)
 Токсично! = COCl2
Токсично! = COCl2  Яд!
Яд!  10 x
COCl2
10 x
COCl2

Номенклатура фторуглеродных соединений:
- В связи с тем, что весь водород может быть заменен фтором, применяют приставку перфтор, которая избавляет от перегруженности названия и его трудности в плане понимания:
CF3CF2CF2I перфтор – н – пропилиодид (1,1,1,2,2,3,3 – гептафторид – 3 – иодпропан)
- В случае присутствия водорода (но не тогда когда его больше фтора!), его обозначают приставкой гидро, с указанием его положения:
CHF2CClFCF3 – 1 – гидро – 2 – хлор – перфторпропан
- Часто названия дают исходя из функциональных групп (тут, правда, мне не все понятно):
C6F5NH2 – перфторанилин (а как же водород при азоте…)
CF2Br2 – 2 – бром – перфторметан
Цифровое обозначение фреонов:
- Пишем фреон или букву F.
- Указываем количество углерода минус один, если ноль то не пишем.
- Указываем количество водорода плюс один.
- Указываем количество фтора.
- Наличие брома указывают буквой B с количеством атомов в соединении.
- Циклическую структуру указываем буквой C.
- Под остатком неиспользуемых атомов подразумеваем хлор.
- Более распространенный изомер (в плане получения) помечаем буквой «а».
Фреон – 12B2; Фреон – 12; Фреон – 11; Фреон – 22; F – 113; F – 114B2; F – C318.
CClF2CClF2 F-114
CCl2FCClF2 F-113
CHClF2 F-22